Ci sono delle controversie per decretare i pionieri del rivoluzionario sistema di editing genetico CRISPR.
CRISPR una disputa infinita per il brevetto
Continuano le controversie fra alcuni gruppi di scienziati, circa la paternità di un brevetto.
Oggetto della contesa è l’invenzione del rivoluzionario strumento di modifica del gene-editing CRISPR-Cas9.
La vicenda si trascina dal 2016 e non lascia intravedere spiragli di risoluzione nel breve termine, almeno questo è il parere dei legali coinvolti nel processo.
Del resto la posta in gioco è molto alta. Si parla di milioni di dollari in royalties.
I team di ricerca si contendono la paternità del CRISPR
I ricercatori che rivendicano la paternità del brevetto sono:
1) Il gruppo guidato dal biologo molecolare Feng Zhang, titolare della cattedra in Neuroscienze del McGovern Institute for Brain Research e del Brain and Cognitive Sciences e Biological Engineering del Massachusetts Institute of Technology;
2) L’altra squadra comprende la biochimica Jennifer Doudna, Professoressa dell’Università della California Berkeley, e la microbiologa Emmanuelle Charpentier, Direttrice del Max Planck Unit for the Science of Pathogens di Berlino. Quest’ultima ha iniziato il suo lavoro sul CRISPR all’Università di Vienna.
Nel 2020, Doudna e Charpentier avevano condiviso il premio Nobel in chimica per lo “sviluppo di un metodo di editing genomico” basato proprio sul CRISPR.
Parliamo della scoperta della cosiddetta “forbice molecolare”, un metodo di editing del genoma Crispr/Cas9, che consente di modificare il DNA delle piante e non solo, studio pubblicato su Science nel 2012.
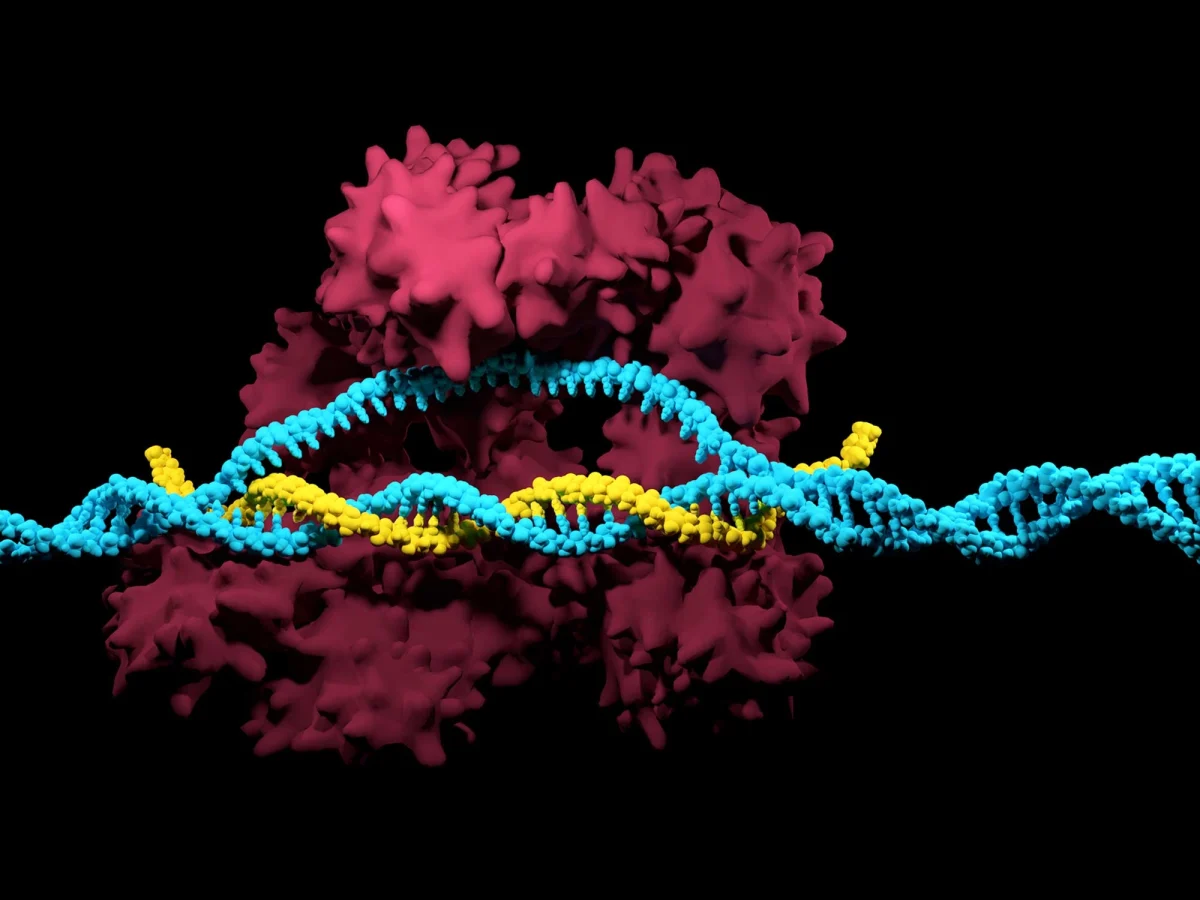
Editing genomico CRISPR: che cos’è e a cosa serve?
CRISPR è l’acronimo di “Clustered Regularly Interspaced Short Palindromic Repeats”, ovvero “sequenze geniche che si ripetono a intervalli regolari”.
Al CRISPR sono associati i geni Cas (“CRISPR associated”, da cui deriva “Crispr-Cas9”) che codificano gli enzimi capaci di tagliare il DNA.
Questo metodo consente di tagliare il DNA, non in modo casuale, ma in un punto preciso, grazie alla presenza di un RNA guida.
Sull’argomento, “L’editing genomico è una tecnologia altamente innovativa che funziona come un correttore di bozze del DNA” riferiscono gli esperti dell’OTA (Osservatorio terapie avanzate).
Tradotto in parole povere, l’editing interviene per trovare e correggere gli errori genetici all’interno dell’intero genoma.
La correzione genetica si può applicare a ogni tipo di cellula: vegetale, animale e umana.
Come nel caso della terapia genica, anche la strategia di editing basata su CRISPR può essere somministrata in vivo (direttamente nell’organismo) o ex vivo (all’esterno, su cellule vive prelevate dell’organismo).
Se i risultati dovessero dare ragione agli studiosi, questa tecnica potrebbe diventare la più importante terapia genica del futuro.
Permetterebbe infatti di correggere direttamente un gene difettoso, senza doverne prendere una copia sana dall’esterno.
Oltretutto, si tratta di una tecnica abbastanza facile da utilizzare, veloce ed economica.
Tutti fattori che contribuiscono ad ampliarne le potenzialità in ambito terapeutico.
Come si è arrivati alla scoperta?
Questo sistema è stato originariamente scoperto nei batteri, nei quali agisce come arma di difesa contro i virus, un po’ come il sistema immunitario umano.
Quali patologie possono beneficiare del CRISPR
L’editing genomico è stato applicato in caso di:
- malattie genetiche,(come la distrofia muscolare di Duchenne, la beta-talassemia e la fibrosi cistica);
- tumori;
- malattie neurologiche (Alzheimer e Parkinson);
- malattie infettive (HIV);
- trapianti di cuore (xenotrapianti), in particolare degli organi suini, per la terapia di malattie umane;
- malattie del sangue;
- amiloidosi transthyretina, una malattia che attacca principalmente il cuore e i nervi;
- anemia falciforme-β-talassemia.
Effetti collaterali della terapia
Tra gli effetti collaterali della terapia, si è notato che infezioni e dolore addominale, si manifestano temporaneamente.
In pratica sarebbero collegati ai trattamenti necessari per preparare il midollo osseo al trattamento.
Il trattamento può causare sterilità.
Limiti della terapia
Sebbene il CRISPR-CAS9 sia stato salutato come un modo rivoluzionario per trattare le malattie, al momento presenta qualche limite.
Come accennato, la tecnica richiede l’intervento di un “enzima di taglio” del DNA, chiamato Cas9 e un pezzo di RNA, chiamato “guida”, che deve essere diretto nel posto esatto nel genoma.
Questi devono essere imballati perfettamente, per evitare che si degradino a contatto con gli agenti esterni.
Il parere degli animalisti
Ultimamente attraverso la tecnica CRISPR, è sono stati trapiantati degli organi modificati con i geni suini.
Gli esperimenti sono stati condotti nell’University of Maryland Medical Center.
Gli xeno-organi hanno dimostrato di funzionare, ma l’annuncio ha riacceso un dibattito che sembrava ormai sopito.
A protestare, gli attivisti per i diritti degli animali, i quali si oppongono all’idea che un’altra specie possa diventare un serbatoio di organi da trapianto e invitano a trovare altre soluzioni.
Fonti e Riferimenti
- Pauling, L., Itano, H. A., cantante, S. J. & Wells, I. C. Scienza 110, 543-548 (1949).
- Articolo PubMed Google Scholar Franndoul, H. et al. N. Engl J. Med. https://doi.org/10.1056/nejmoa2031054 (2020).
- Articolo Google Scholar Esrick, E. B. et al. N. Engl J. Med. https://doi.org/10.1056/nejmoa2029392 (2020)
- Riferimenti Gillmore, J. D. et al. N. ENGL. J. med. https://doi.org/10.1056/nejmoa2107454 (2021).
- Osservatorio terapie avanzate OTA
- Studio di Intelaia Therapeutics di Cambridge, Massachusetts e Regeneron di Tarrytown, New York, pubblicato su New England Journal of Medicine
Simona Mazza